| Térjünk ki itt néhány sor erejéig arra, mi is az a mitokondrium
A mitokondrium a sejt energiaközpontja. Ezt egy kettős membrán fogja körül. Ennek belső rétege nagy felülettel rendelkezik. Ezen zajlódnak le a sejtlégzési folyamatok. Ezek összfelülete egy embernél 100 ezer m2-t tesz ki.
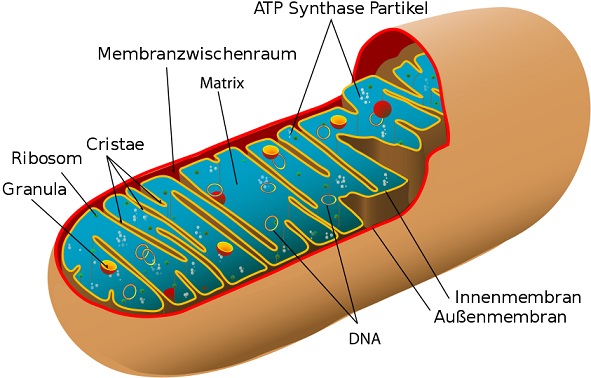 Sejtenként 1500 mitokondriummal és 2 milliárd sejttel számolva az ember kb. 3000 milliárd mitokondriummal rendelkezik. A táplálékok lebontásánál keletkező köztes termékek, mint piruvát (a piroszőlősav anionja) és zsírsavak a kettős membránon keresztül jutnak a mitokondriumba további lebontásra. A folyamatot oxidatív foszforilációnak nevezzük. Ennek során keletkezik a szervezet fő energiahordozója, az adenozin-trifoszfát. A folyamatokat enzimek vezérlik, melyek kémiai tényezők változásával csökkentik vagy növelik aktivitásukat. A sejt, a mitokondrium, a sejtmag működése egy nagyon bonyolult, automatikus, önszabályzó vegyiüzemhez hasonlítható. Az egyik fő szabályzótényező a Ca++ (kalcium)-ion. Sejtenként 1500 mitokondriummal és 2 milliárd sejttel számolva az ember kb. 3000 milliárd mitokondriummal rendelkezik. A táplálékok lebontásánál keletkező köztes termékek, mint piruvát (a piroszőlősav anionja) és zsírsavak a kettős membránon keresztül jutnak a mitokondriumba további lebontásra. A folyamatot oxidatív foszforilációnak nevezzük. Ennek során keletkezik a szervezet fő energiahordozója, az adenozin-trifoszfát. A folyamatokat enzimek vezérlik, melyek kémiai tényezők változásával csökkentik vagy növelik aktivitásukat. A sejt, a mitokondrium, a sejtmag működése egy nagyon bonyolult, automatikus, önszabályzó vegyiüzemhez hasonlítható. Az egyik fő szabályzótényező a Ca++ (kalcium)-ion.
Az emberi szervezet működése az elektronok áramlásától, mint az élet hajtóanyagától függ.
A mitokondriumban a piruvát és a zsírsavak a legkisebb energiagazdag egységekig bomlanak le, hogy aztán ATP-tá épüljenek fel. Az elektronmozgás mindig a magasabb energiájú helyről az alacsonyabb energiaszintű fogadómolekula felé történik. A folyamat végén a protonok és elektronok a belélegzett és a vér hemoglobin által a sejtbe szállított oxigénnel reagálnak és az ATP mellett víz keletkezik. Az egész folyamatot redoxreakciónak nevezzük. Lényeges, hogy az elektront leadó molekula elektronjai megfelelően magas energiaszinten legyenek, azaz redoxpotenciáljuk erősen negatív legyen.
Ezt az erős negatív redoxpotenciált a redukált glutation biztosítja. A glutation három aminosavból épül fel (glutamin, cisztein, glicin).
A mitokondriumok génanyaga kevésbé védett, mint a sejtmagé, ezért érzékenyebbek a gyógyszerek mellékhatásaira.
A mitokondrium funkciózavarának esetében több oxidáns keletkezik, ami az ATP anaerob szintézisét hozhatja magával.
Az emberi sejtek 1 %-a naponta elhal és lebomlik. Természetesen ugyanannyi keletkezik is. A sejt halála kétféle módon mehet végbe.
a, A sejtek programozott halála, az apoptózis.
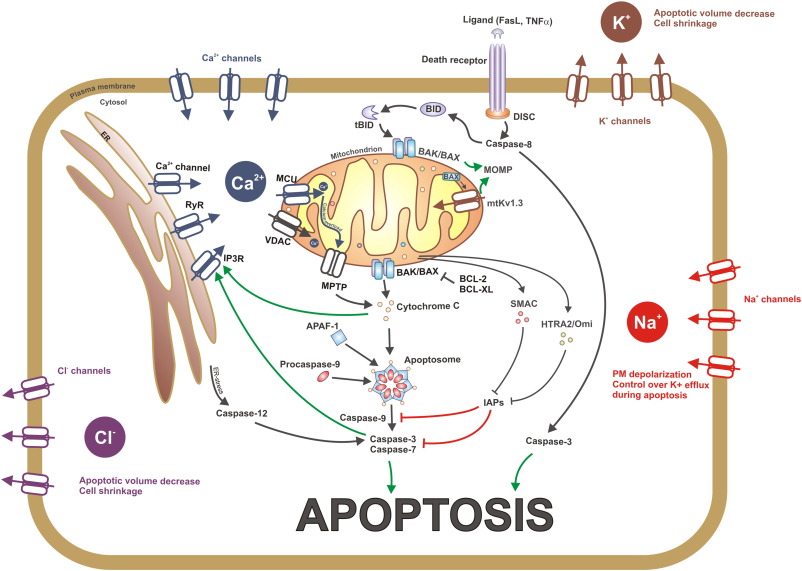 Normális esetben az ATP-szintézis egy kritikus értékre csökken a mitokondriumban. Peroxinitrit keletkezik, aminek következtében kinyílnak a mitokondrium zsilipjei. Ca++ ionok áramolnak a sejtplazmába, ahol aktiválják a fehérjék és sejtmag nukleinsavak lebomlását irányító enzimeket. Normális esetben az ATP-szintézis egy kritikus értékre csökken a mitokondriumban. Peroxinitrit keletkezik, aminek következtében kinyílnak a mitokondrium zsilipjei. Ca++ ionok áramolnak a sejtplazmába, ahol aktiválják a fehérjék és sejtmag nukleinsavak lebomlását irányító enzimeket.
b, Fertőzés, toxikus, farmakotoxikus oxidatív stressz esetében az ATP-szintézis túl gyorsan áll le, ami nekrózishoz, rendezetlen sejthalálhoz vezet. A sejt alkotói, fehérjék és nukleinsavak a sejtközötti térbe jutnak, ahol gyulladásokat és autoimmunreakciókat váltanak ki.
Ha az ATP-szintézis aktivitása a mitokondriumban egy bizonyos érték körül ingadozik, nem kerül sor a sejt elhalására. Arra akkor kerül sor, ha toxikológiai, farmatoxikológiai, traumatikus, fertőzésből, hormonális vagy helytelen táplálkozásból eredő okokból krónikus oxidatív stressz lép föl, ami gátolja a mitokondrium funkcióját. Az osztódásban lévő sejtekben (anaerob légzés) nem történik meg az átváltás az aerob ATP-szintézisre, és így a sejt megmarad osztódó állapotában. Rákos sejt keletkezik.
Ezt az állapotot a sejtlégzés regenerációja tudná megszüntetni.
Ha a szervátültetésen átesett betegeket a Cyclosporin A (CSA) nevű immunszupresszív gyógyszerrel kezelték, többen közülük rákban betegedtek meg. Bebizonyosodott, hogy a CSA megakadályozta a természetes sejtelhalást, ez vezetett a rákos sejtek burjánzásához.
A rák, immungyöngeség, vastagbélgyulladás, súlyos traumák stb. összefüggésbe hozhatók a cisztein- és glutationhiánnyal. Ennek oka a szervezet nagyobb felhasználása ezekből az anyagokból az oxidáló anyagok méregtelenítésére vagy a cisztein képződésének gátlása a májban folsavgátlók (Bactrim) hatására vagy a glutation képződésének gátlása.
Az anaerob ATP-termelés a sejtosztódáskor normális, ennek befejeztével viszont a mitokondrium átáll az aerob ATP-gyártásra. Nos, ha a glutationhiány elér egy bizonyos értéket, a sejt megmarad az anaerob ATP-képzésnél, ami azt jelenti, hogy a sejtek osztódása nem fejeződik be, burjánzani kezdenek. A rákos sejtekben a mitokondriumok elsorvadnak, és nem tud végbemenni az apopteózis sem.
Glutation- és ciszteinhiány, mint a kiszáradás (kachexia, wasting) oka
Tudjuk, hogy a rákbetegségek egyik tünete a kachexia (kiszáradás).
A kachexia egyrészt a ciszteinhiány következménye, mivel az aminosavak kiválasztásra kerülnek karbamidként, anélkül, hogy proteinekké épüljenek fel, vagy hogy hasznosuljanak a glutamin és arginin szintézisénél. Másrészt az energiatermelés a rákos sejtekben anaerob módon, a sejtplazmában lejátszódó glikolízissel történik, ami húszszoros glükózfelhasználást, illetve a keletkező laktát májban történő feldolgozását jelenti. A rákos sejt fehérjebontó enzimeket termel, amelyek megtámadják a szövetek és az izomzat cukor-fehérje struktúráit, hogy glükózt tudjanak termelni. Amíg a vérplazma ciszteinszintje normális, a kiválasztott karbamid mennyisége is normális. Viszont alacsony ciszteinszint azt eredményezi, hogy a szervezet szükségmegoldásként lebontja az izomzat proteinjeit, hogy így ciszteinhez jusson.
A mai orvostudomány nem ismeri fel a cisztein jelentőségét, mert azon a véleményen van, hogy a szervezet elő tud állítani ciszteint metioninból. Igenám, de rákos betegeknél (és még néhány betegségnél, amiket AIDS néven foglaltak össze) az ezt katalizáló enzim termelése gátolva van. A cisztein szintézisét gátolja továbbá a folsavhiány, valamint a biológiailag aktív folátok gátlása, Methotrexat, Bactrim és analóg termékek bevitele által.
Tehát éppen a rák- és AIDS-páciensek — akiknek betegsége a glutation- és ciszteinhiánnyal függ össze — kapnak olyan szereket, amelyek ezeknek az életfontosságú anyagoknak a szintézisét gátolják.
Az ötvenes években kezdték az antibiotikumokat kifejleszteni. A cél az volt, hogy olyan anyagokat fejlesszenek ki, amelyek gátolják a bioszintézist a kórokozó mikrobák DNS-eiben és a rákos sejtekben. Ezeknek az anyagoknak valóban volt gátló hatása a kórokozókra, de emellett gyöngítették az immunrendszert is.
 A Bactrim (Cotrimoxazole, T+S) két fő vegyianyag – trimetoprim és szulfamethoxazol – kombinációjából, álló gyógyszer, opportunista rejtőző, majd gyönge immunrendszer esetén kitörő fertőzések kezelésére. A Bactrim (Cotrimoxazole, T+S) két fő vegyianyag – trimetoprim és szulfamethoxazol – kombinációjából, álló gyógyszer, opportunista rejtőző, majd gyönge immunrendszer esetén kitörő fertőzések kezelésére.
A Bactrim kétféle módon gátolja a folsav képződését.
a) A trimethoprim megköti a dihidrofolátreduktáz (DHFR) emnzimet,
amely a folsavat a biológiailag aktív tetrahidrofolát (THF) formába viszi át. A THF szabályozza a DNS nukleobázisok és több koenzim szintézisét. A DHFR gátlása, ill. a THF hiánya a DNS-szintézis, egyes koenzimek szintézisének és néhány aminosav anyagcseréjének zavarához vezet. A Methotrexat elsősorban a rákos sejtekben fejti ki hatást, de zavarja a normális sejtek működését is, amely a kemoterápia rettegett mellékhatásaiban nyilvánul meg.
b) A szulfamethoxazol (Sulfonamid) gátolja azt az enzimet,
amely szabályozza a para-aminobenzoesav PAB beépülését a folsavba. A legtöbb baktérium és gomba nem tud kész folsavat szállítani sejtmembránjain keresztül, hanem a sejten belül szintetizálja ezeket.
Ezt gátolja a szulfamethoxazol. Az emberi szervezet a folsavat föl tudja venni a táplálékból, de hogy az a mitokondriumba jusson, föl kell bontania három alkotójára, amelyeket a mitokondriumban aztán újra szintetizál. A szulfonamidok a folyamatot gátolják.
A kemoterápia fő dilemmája, hogy a vegyianyagok nem csak a rákos sejteket támadják, hanem a bakteriális jegyeket felmutató, a vegyianyagokra jóval érzékenyebb mitokondriumokat is. |